产品货号:
M20028
中文名称:
无缝克隆试剂盒
英文名称:
Seamless DNA Assembly Plus Kit
产品规格:
50T
发货周期:
1~3天
产品价格:
询价
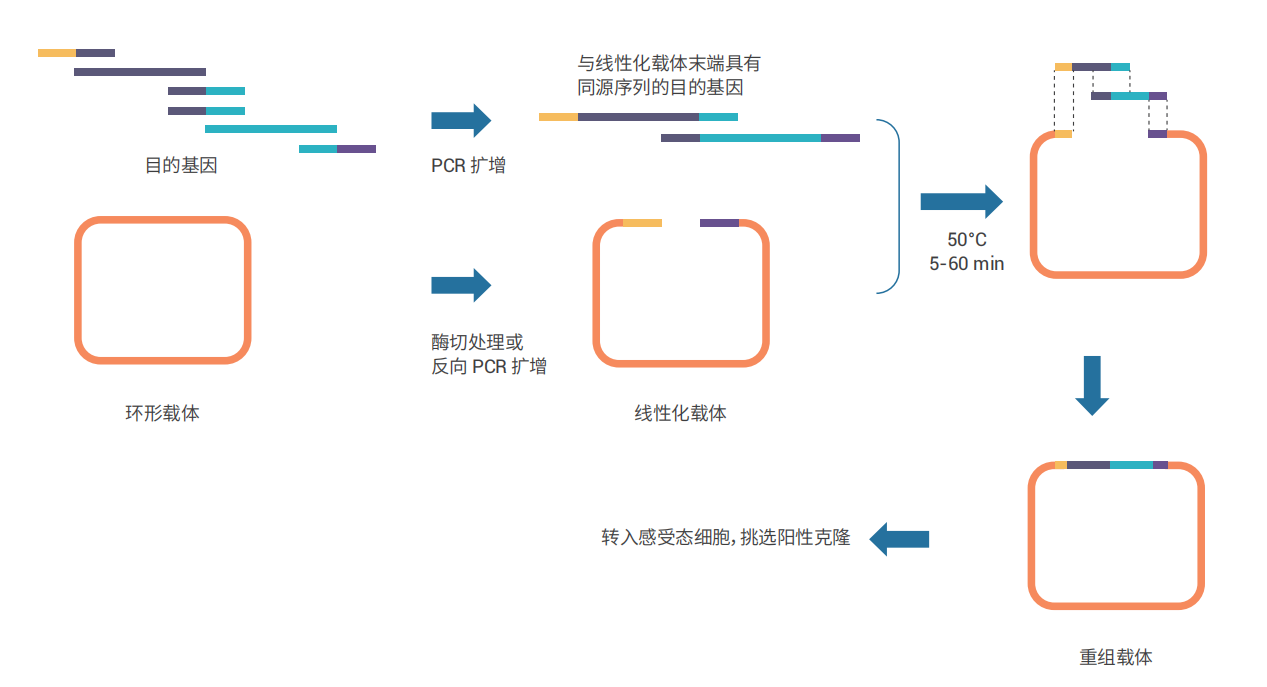
本制品为新一代重组克隆试剂盒,一次反应可完成单个至多个DNA片段的重组。其中经优化的Mix预混了重组酶和反应缓冲液,并添加了辅助因子,可显著提高克隆的重组效率和对杂质的耐受度,最快仅需5分钟即可完成单片段重组,且阳性率高达95%以上。

与传统的克隆方法不同,无缝克隆技术基于基因重组原理,在目的基因引物5'端引入了一段与线性化载体末端同源的碱基序列(一般为15~20bp),在重组酶的作用下即可将目的基因插入线性化载体中,是一种操作简单、高效且快速的DNA定向克隆技术。

| 组分 | 规格 |
| Seamless Assembly Mix Plus | 250μL |
| pUC19 Control Plasmid,Linearized (Ampr,40ng/μL) | 5μL |
| 500bp Control Fragment (20ng/μL) | 5μL |
保存:-20℃,避免反复冻融,有效期2年。

- 载体线性化处理
选择合适的克隆位点,对环形载体进行线性化处理。以下两种方法任选其一即可。- 酶切处理
建议使用双酶切,可减少载体自连,降低假阳性克隆概率。若使用单酶切,建议适当延长酶切反应时间。酶切处理后,建议进行电泳验证,并对线性化载体切胶纯化。 - 反向PCR扩增
以预线性化质粒为模板,推荐选择MCE高保真聚合酶(例如2×高保真PCR预混液)进行扩增。
- 酶切处理
- 目的基因扩增
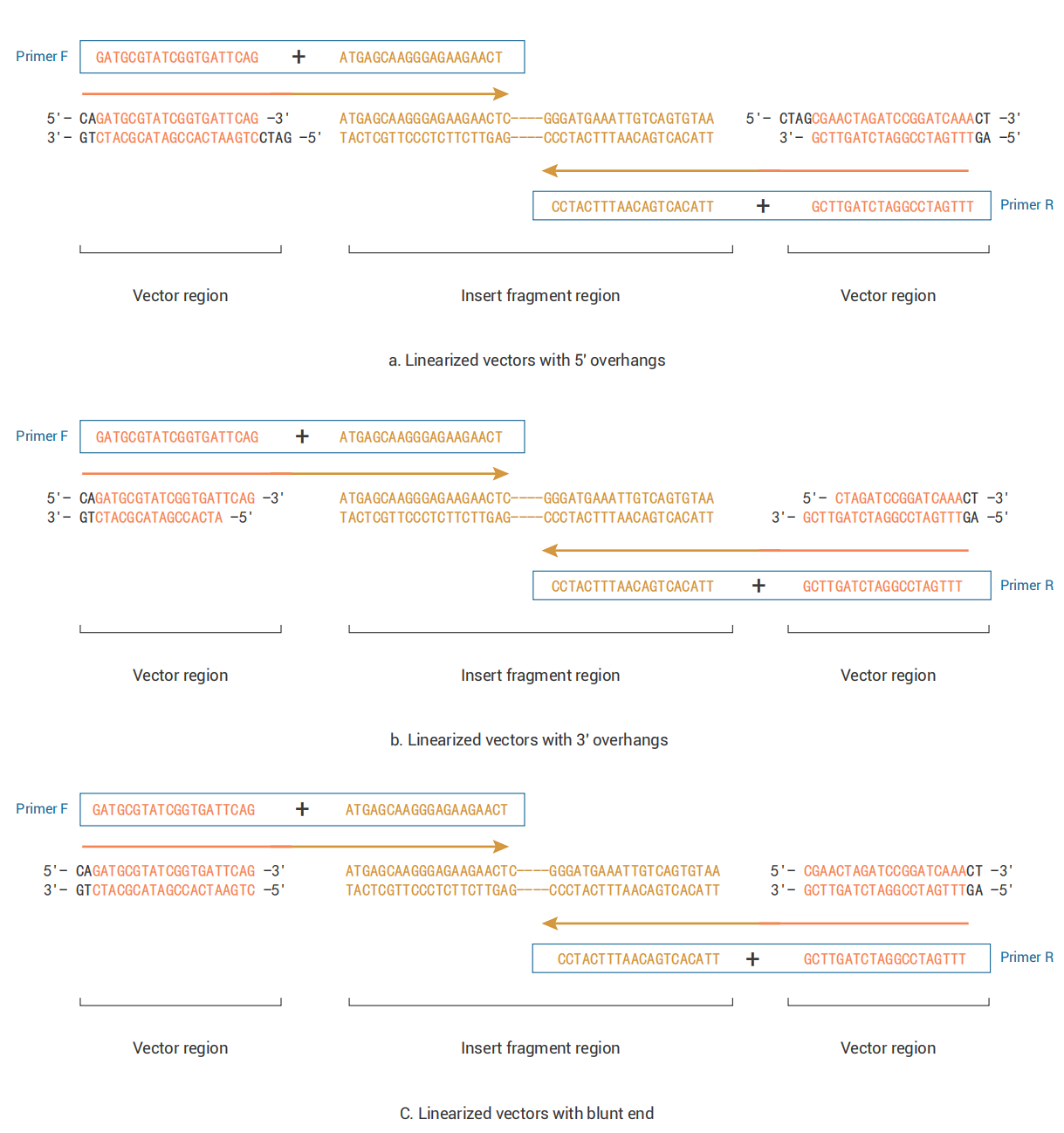
- 目的基因引物设计原则
无缝克隆反应要求目的基因与相邻片段具有15~20bp的末端同源性,所以目的基因上下游引物的5'端均需包含一段与已知线性化载体末端同源的碱基序列,引物总长度最好不要超过40bp,Tm值一般在55~65℃,GC含量一般在40~60%。- 上游引物(Primer F):
5'—上游载体末端同源序列+酶切位点(可选择)+目的基因特异性正向序列—3' - 下游引物(Primer R):
3'—目的基因特异性反向序列+酶切位点(可选择)+下游载体末端同源序列—5'
- 目的基因特异性正\反向序列即常规插入片段正\反向扩增引物序列。
- 上游\下游载体末端同源序列为线性化载体最末端序列(用于同源重组)。
- 上游引物(Primer F):
- 目的基因PCR扩增
推荐选择高保真聚合酶(例如2×高保真PCR预混液)进行扩增。扩增结束后,建议对PCR产物进行纯化后再用于后续无缝克隆反应。
- 目的基因引物设计原则
- 无缝克隆
- 在冰上配制如下反应体系:
成分 实验组 阴性对照 阳性对照 Seamless Assembly Mix Plus 5μL 5μL 5μL 线性化载体 50~200ng 50~100ng / 目的基因 10~200ng / / pUC19 Control Plasmid,Linearized / / 1μL 500bp Control Fragment / / 1μL ddH2O 至10μL 至10μL 至10μL - 本反应体系最适载体用量为0.03pmol。
- 当插入单个目的基因时,目的基因与载体的最适摩尔比为2:1。
- 当插入多个目的基因时,每个目的基因与载体的最适摩尔比为1:1。
摩尔比= 载体浓度(ng/μL)×载体体积(μL)×目的基因大小(bp) 目的基因浓度(ng/μL)×目的基因体积(μL)×载体大小(bp) - 若目的基因长度大于载体长度时,应互换载体与目的基因的用量,即将目的基因当做载体,将载体当做目的基因再进行计算。
- 线性化载体的使用量在50~200ng之间,目的基因的使用量在10~200ng之间。若按照上述公式计算得到的使用量超出这个范围,建议直接选用最低/最高使用量。
- 若目的基因小于200bp时,建议目的基因与载体的摩尔比为5:1。
- 若使用未经纯化的线性化载体或目的基因时,加样体积不应超过总反应体积的20%。
- 载体或目的基因片段过长均会导致重组效率降低。
- 本反应体系最适载体用量为0.03pmol。
- 用移液枪轻轻吹打混匀(切勿振荡),短暂离心后置于50℃反应5~60min。
- 推荐使用PCR仪等温控较精准的仪器,反应时间过长或过短均会降低克隆效率。
- 当插入1~2个片段时,推荐反应5~15min;当插入3~5个片段时,推荐反应15~30min。
- 若载体大于10kb或目的基因大于4kb时,建议延长反应至30~60min。
- 推荐使用PCR仪等温控较精准的仪器,反应时间过长或过短均会降低克隆效率。
- 将反应液短暂离心后置于冰上冷却,用于后续转化。
- 重组产物可于-20℃暂存一周,待需要时解冻转化即可。
- 在冰上配制如下反应体系:
- 转化
- 在冰上解冻100μL感受态细胞。禁止直接用手化冻,会影响感受态细胞的活性。
- 在解冻后的感受态细胞中,加入10μL重组产物,轻轻混匀,在冰上放置30min。
- 将上述反应液于42℃水浴热激45-60 s,迅速放到冰上冷却5min。
- 加入500μL LB或者SOC液体培养基(不含抗生素),37℃,180rpm培养1h。
- 将菌液离心浓缩后涂布在含相应抗生素的固体平板上,37℃倒置培养过夜。
- 不同感受态细胞的阳性克隆率有所区别,推荐使用转化效率较高的感受态细胞。
- 阳性对照平板通常出现大量菌落,而阴性对照几乎没有菌落。
- 不同感受态细胞的阳性克隆率有所区别,推荐使用转化效率较高的感受态细胞。
- 在冰上解冻100μL感受态细胞。禁止直接用手化冻,会影响感受态细胞的活性。
- 阳性克隆子的筛选与鉴定
过夜培养后,理论上重组平板会出现数百个单菌落,挑取单菌落进行验证。以下两种方法任选其一即可。- 为确保实验准确性,建议将以下两种方法筛选出的阳性克隆子测序。
- 酶切验证:挑取单菌落接种至含抗生素的液体培养基中培养,提取质粒后进行酶切验证。
- 菌落PCR:挑取单菌落至10μL ddH2O,95℃裂解10min。取1μL裂解液作为模板,直接进行菌落PCR。菌落PCR扩增时至少使用一条通用引物,以免造成假阳性。

| 问题 | 原因 | 解决办法 |
| 转化效率低 | 感受态细胞效率低 | 使用新制备或妥善保存的感受态细胞;在冰上化冻感受态细胞。 |
| DNA片段比例不佳 | 根据说明书推荐的最适用量和比例配制反应体系。用超微量核酸蛋白检测仪等测定线性化载体及目的基因的浓度,且需确保OD260/OD280在1.8-2.0。 | |
| DNA片段纯度不够 | 对线性化载体和目的基因切胶纯化,并将纯化产物溶解在ddH2O中。切勿使用Tris-EDTA等缓冲液。 | |
| 多数克隆不含目的基因 | 载体线性化不完全 | 加大快速内切酶的使用量;延长酶切反应时间;使用胶回收纯化酶切产物。 |
| 平板抗性不足 | 使用正确抗生素;使用新制备的抗生素平板。 | |
| 多数克隆含有不正确插入片段 | 非特异性PCR扩增产物 | 优化PCR体系,使用高保真酶,提高特异性;对PCR产物进行切胶回收;鉴定更多克隆。 |
相关搜索:无缝克隆试剂盒,无缝克隆,Seamless DNA Assembly Plus Kit



